Portelite 快速荧光法内毒素检测试剂盒
| Ex (nm) | - | Em (nm) | - |
| 分子量 | N/A | 溶剂 | - |
| 存储条件 | - |
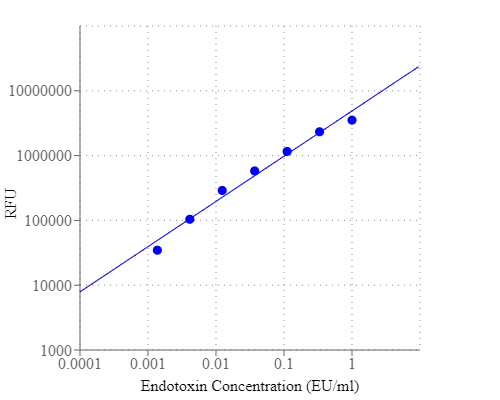
脂多糖( LPS ),也称为内毒素,是革兰氏阴性菌外膜的主要成分。LPS是脊椎动物先天免疫系统的强力刺激剂,可引起发烧、感染性休克、死亡。它也被认为是检测细菌病原体入侵的生物标志物,并在极端情况下负责炎症反应和内毒素休克的发展。在生物材料,如蛋白质、多肽或抗体样品中检测LPS是生物制造和生物加工的一项重要任务。Portelite 快速荧光内毒素检测试剂盒使用Endotoxin Green,一种敏感的荧光底物。Endotoxin Green可以在内毒素和鲎血细胞提取物鲎素( LAL )的存在下水解,产生强烈的绿色荧光。内毒素活性与Endotoxin Green水解产生的荧光强度成正比。该试剂盒针对Cytocite™和Qubit™荧光仪进行了优化,可以检测样品中广泛存在的内毒素(从1 EU / ml到0.002 EU / ml)。
适用仪器
| CytoCite荧光计 | |
| Ex: | 480nm |
| Em: | 510-580nm |
| 耗材推荐: | 0.2 mL, 薄壁PCR管 |
样品分析方案
概述
制备细胞裂解液(LAL)工作溶液
添加大肠杆菌内毒素标准品和测试样品(50µL)
添加LAL工作溶液(50µL)
在37°C下孵育30分钟
准备并添加Endotoxin Green工作溶液(100µL)
用CytoCite监测荧光
溶液配制
储备溶液配制
1.Endotoxin Green储备液
对于试剂盒#60008,将50µL DMSO加入一小瓶Endotoxin Green中 (组分A)制备内毒素底物储备溶液。对于试剂盒#60009,将500µL DMSO加入一小瓶Endotoxin Green中 (组分A)制备内毒素底物储备溶液。 注意避光。
2.LAL细胞裂解液储备液
对于试剂盒#60008,将500µL无内毒素水(组分B)添加到LAL试剂瓶(组分C)中,制成5倍LAL储备溶液。对于试剂盒#60009,将2.5 mL无内毒素水(组分B)添加到LAL试剂瓶(组分C)中,制成5倍LAL储备溶液。
标准溶液配制
E、 大肠杆菌内毒素标准溶液
将10µL 100 EU/mL大肠杆菌内毒素标准溶液添加到990µL无内毒素水(组分B)中,生成1 EU/mL的大肠杆菌内毒素溶液。然后取1 EU/mL大肠杆菌内毒素标准溶液,在无内毒素水(组分B)中进行1:3的连续稀释,以获得连续稀释的大肠杆菌内毒素1至0.001 EU/mL。
工作溶液配制
1. Endotoxin Green工作溶液
对于试剂盒#60008,添加50µLEndotoxin Green 将储备溶液溶于5mL无内毒素水(组分B)中,使总体积为5.05mL Endotoxin Green工作溶液。对于试剂盒#60009,添加500µLEndotoxin Green 将储备溶液溶于50mL无内毒素水(组分B)中,使总体积为50.5mLEndotoxin Green工作溶液。 注:每次测试需要100µL,请将工作溶液避光,将未使用的储备溶液储存在-20°C。
2. LAL工作溶液
对于试剂盒#60008,将500µL LAL细胞裂解液储备溶液添加到2 mL无内毒素水(组分B)中,使总体积为2.5 mL LAL细胞裂解液(LAL)工作溶液。对于试剂盒#60009,将2.5 mL LAL细胞裂解液(LAL)储备溶液添加到10 mL无内毒素水(组分B)中,使总体积为12.5 mL LAL裂解液工作溶液。
操作步骤
1.在0.2 mL PCR管(Cat#CCT100)中制备大肠杆菌内毒素标准品、空白对照品或测试样品(50µL)。
2.向每管大肠杆菌内毒素标准品、空白对照品和测试样品中加入50µL鲎红细胞裂解液工作溶液。
3.充分混合并在37°C下孵育30分钟。
4.添加100µLEndotoxin Green 每管内毒素标准品、空白对照品和测试样品的工作溶液,使总分析体积为200µL/孔。
5.将样本放入CytoCite 并用绿色荧光通道监测荧光。
CytoCite的程序详细说明,请参见下面的链接:https://devices.aatbio.com/documentation/user-manual-for-cytocite-fluorometer.
注:为获得良好结果,在添加工作溶液后2至10分钟内读取。
注:可加入50µL 25%乙酸以停止反应。
试剂应用文献
Authors: Sheraba, N. S., Diab, M. R., Yassin, A. S., Amin, M. A., Zedan, H. H.
Journal: PDA J Pharm Sci Technol (2019): 562-571
Authors: Uchida, T., Kaku, Y., Hayasaka, H., Kofuji, M., Momose, N., Miyazawa, H., Ueda, Y., Ito, K., Ookawara, S., Morishita, Y.
Journal: Med Devices (Auckl) (2019): 429-433
Authors: Suzuki, Y., Suzuki, K., Shimamori, T., Tsuchiya, M., Niehaus, A., Lakritz, J.
Journal: J Vet Med Sci (2016): 49-53
Authors: Mukherjee, S. P., Lozano, N., Kucki, M., Del Rio-Castillo, A. E., Newman, L., Vazquez, E., Kostarelos, K., Wick, P., Fadeel, B.
Journal: PLoS One (2016): e0166816
Authors: Seto, J., Suzuki, Y., Ahiko, T.
Journal: Kekkaku (2016): 49-52
Authors: Schaumberger, S., Ladinig, A., Reisinger, N., Ritzmann, M., Schatzmayr, G.
Journal: AMB Express (2014): 1
Authors: Chen, L., Mozier, N.
Journal: J Pharm Biomed Anal (2013): 180-5
Authors: Hasiwa, N., Daneshian, M., Bruegger, P., Fennrich, S., Hochadel, A., Hoffmann, S., Rivera-Mariani, F. E., Rockel, C., Schindler, S., Spreitzer, I., Stoppelkamp, S., Vysyaraju, K., Hartung, T.
Journal: ALTEX (2013): 169-208
Authors: Smulders, S., Kaiser, J. P., Zuin, S., Van L and uyt, K. L., Golanski, L., Vanoirbeek, J., Wick, P., Hoet, P. H.
Journal: Part Fibre Toxicol (2012): 41
Authors: Sharma, S., Mittal, B. R., Vatsa, R., Singh, B.
Journal: Indian J Nucl Med (2011): 149-52