Cell Meter 钙检测流式细胞仪分析检测试剂盒
| Ex (nm) | 493 | Em (nm) | 515 |
| 分子量 | - | 溶剂 | - |
| 存储条件 | - |
Cell Meter 钙检测流式细胞仪分析检测试剂盒提供了基于荧光的测定法,用于使用流式细胞仪检测细胞内钙动员。它可以用于动力学读数或终点读数。将Calbryte 520 AM染料加载到细胞中后,只需洗涤细胞并添加钙通量激动剂,即可通过流式细胞仪使用动力学读取模式或终点读取模式读取样品。 Calbryte 520 AM可以通过扩散被动地穿过细胞膜。一旦进入细胞内部,Calbryte 520 AM的亲脂性封闭基团就会被酯酶裂解,产生带负电荷的荧光染料,并留在细胞内部。与钙结合后,其荧光大大增强。当用激动剂刺激表达目的GPCR的细胞时,受体会发出释放细胞内钙的信号,这会明显增加Calbryte 520的荧光。Cell Meter 钙检测流式细胞仪分析检测试剂盒也可用于检测细胞钙通量作为细胞分选。百萤生物是AAT Bioquest的中国代理商,为您提供优质的Cell Meter 钙检测流式细胞仪分析检测试剂盒。
适用仪器
| 流式细胞仪 | |
| 激发: | 488nm激光 |
| 发射: | 530/30nm滤波片 |
| 通道: | FITC通道 |
| 其他可用仪器: |
| FDSS, ViewLux, NOVOStar, ArrayScan, FlexStation, IN Cell Analyzer |
样品实验方案
简要概述
- 在测定缓冲液中准备细胞
- 添加Calbryte 520 AM染料加载溶液(1 µL)
- 在37°C孵育30分钟
- 清洗细胞
- 添加钙通量激动剂
- 在530/30 nm滤光片(FITC通道)使用流式细胞仪检测荧光强度
溶液配制
储备溶液配制
Calbryte 520 AM储备溶液(500X):在Calbryte 520 AM储备溶液(组分A)的小瓶中加入100 µL DMSO(未提供),并充分混合。 注意:100 µL Calbryte 520 AM储备溶液足以进行100次测定。 如果试管密封严密,可以将未使用的Calbryte 520 AM原液分装并在<-20°C下保存超过一个月。 避光并避免重复的冻融循环。
实验步骤
1.除去细胞培养基,并加入0.5 mL测定缓冲液。注意:对于贴壁细胞和非贴壁细胞,建议分别使用4 x 105 – 8 x 105和1 x 106-2 X 106。每个细胞系应根据个体情况进行评估,以确定细胞内钙动员的细胞密度。
2.将1µL Calbryte 520 AM储备溶液(500X)加到0.5 mL非标准或贴壁细胞的测定缓冲液(组分B)中。注意:如果细胞(例如CHO细胞)含有有机阴离子转运蛋白,则可将丙磺舒(组分C)添加到染料工作溶液中(孔浓度将为0.125-1 mM),以减少去离子水的泄漏。
3.将细胞在37°C下孵育30分钟。
4.对于非贴壁细胞,将细胞离心并去除染料。将细胞重悬于0.4 mL HHBS(组分D)中。对于贴壁细胞,使用0.5 mM EDTA轻轻地将细胞从板中提起并离心。将细胞重悬于0.4 mL HHBS(组分D)中。注意:要从板上分离贴壁细胞,可以考虑使用酶试剂(例如胰蛋白酶,Accutase),但需要进行测试以确保细胞表面上的目标受体不受影响。
5.用HHBS或所需的缓冲液制备5X激动剂化合物。
6.使用530/30 nm滤光片(FITC通道)在流式细胞仪上检测,在添加100 µL制备的激动剂之前和之后分析样品。注意:为获得结果,重要的是在添加激动剂后1分钟内进行测定。确保激动剂添加到实际读数开始之间的时间对于所有样品保持恒定。
图示
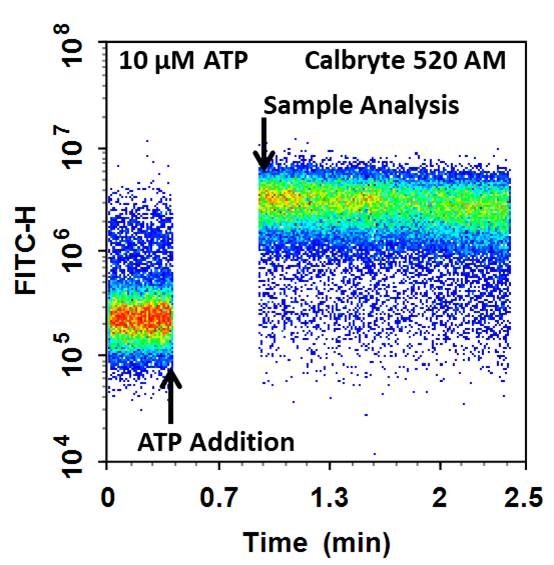 图1.通过Cell Meter 流式细胞钙测定试剂盒在CHO-K1细胞中测量了ATP诱导的细胞内钙释放。将细胞与Calbryte 520 AM染料在37°C下孵育30分钟,然后向细胞中添加10μM的ATP, 在加入ATP后,获得基线并分析其余细胞。这种反应是随着时间的推移而测量的。分析在NovoCyte 3000流式细胞仪上进行。图表上的箭头表示添加ATP和实际分析之间的时间(30秒)。 |
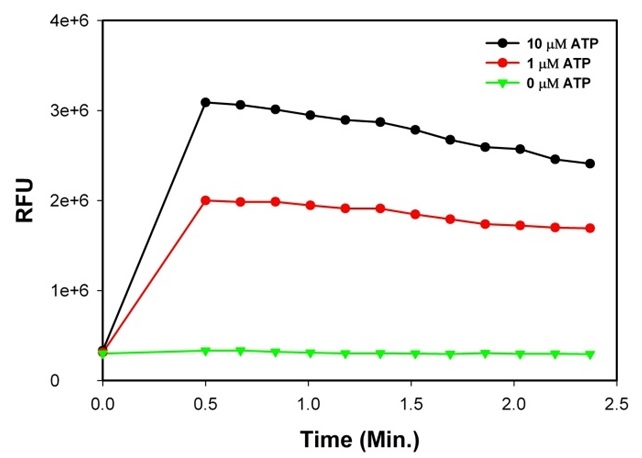 通过Cell Meter 流式细胞钙测定试剂盒在CHO-K1细胞中测量了ATP诱导的细胞内钙释放。将细胞与Calbryte 520 AM染料在37°C下孵育30分钟,然后向细胞中添加10μM的ATP, 在加入ATP后,获得基线并分析其余细胞。这种反应是随着时间的推移而测量的。分析在NovoCyte 3000流式细胞仪上进行。图表上的箭头表示添加ATP和实际分析之间的时间(30秒)。B.荧光信号随时间的变化。 |
相关产品
Fluorescence absorbance inner-filter decomposition: the role of emission shape on estimates of free Ca(2+) using Rhod-2
Authors: Territo PR, Heil J, Bose S, Evans FJ, Balaban RS.
Journal: Appl Spectrosc (2007): 138
Kinetic characterization of novel NR2B antagonists using fluorescence detection of calcium flux
Authors: Bednar B, Cunningham ME, Kiss L, Cheng G, McCauley JA, Liverton NJ, Koblan KS.
Journal: J Neurosci Methods (2004): 247
Novel fluo-4 analogs for fluorescent calcium measurements
Authors: Martin VV, Beierlein M, Morgan JL, Rothe A, Gee KR.
Journal: Cell Calcium (2004): 509
Protein kinase C and myocardial calcium handling during ischemia and reperfusion: lessons learned using Rhod-2 spectrofluorometry
Authors: Stamm C, del Nido PJ.
Journal: Thorac Cardiovasc Surg (2004): 127
Cytosolic calcium in the ischemic rabbit heart: assessment by pH- and temperature-adjusted rhod-2 spectrofluorometry
Authors: Stamm C, Friehs I, Choi YH, Zurakowski D, McGowan FX, del Nido PJ.
Journal: Cardiovasc Res (2003): 695
Calcium measurements in perfused mouse heart: quantitating fluorescence and absorbance of Rhod-2 by application of photon migration theory
Authors: Du C, MacGowan GA, Farkas DL, Koretsky AP.
Journal: Biophys J (2001): 549
Calibration of the calcium dissociation constant of Rhod(2)in the perfused mouse heart using manganese quenching
Authors: Du C, MacGowan GA, Farkas DL, Koretsky AP.
Journal: Cell Calcium (2001): 217
Changes in mitochondrial Ca2+ detected with Rhod-2 in single frog and mouse skeletal muscle fibres during and after repeated tetanic contractions
Authors: Lannergren J, Westerblad H, Bruton JD.
Journal: J Muscle Res Cell Motil (2001): 265
Rhod-2 based measurements of intracellular calcium in the perfused mouse heart: cellular and subcellular localization and response to positive inotropy
Authors: MacGowan GA, Du C, Glonty V, Suhan JP, Koretsky AP, Farkas DL.
Journal: J Biomed Opt (2001): 23
Mitochondrial free calcium levels (Rhod-2 fluorescence) and ultrastructural alterations in neuronally differentiated PC12 cells during ceramide-dependent cell death
Authors: Muriel MP, Lambeng N, Darios F, Michel PP, Hirsch EC, Agid Y, Ruberg M.
Journal: J Comp Neurol (2000): 297




