链霉亲和素-Xtra IF488缀合物
| Ex (nm) | 491 | Em (nm) | 516 |
| 分子量 | ~52000 | 溶剂 | Water |
| 存储条件 | 避免光照, 在2-8度冷藏保存 |
链霉亲和素缀合物广泛用于和生物素缀合物结合以检测多种生物靶标,例如蛋白质,核酸和其他分子。它们被用作许多生物检测的理想选择,例如免疫荧光显微镜,流式细胞术,蛋白质印迹和其他生物应用,因为链霉亲和素具有很强的亲和力结合生物素,在广泛的pH和温度范围内都不会受到影响。AAT Bioquest®提供多种标记有经典荧光染料的链霉亲和素偶联物(例如:FITC,TRITC,TexasRed®,Cy3®,Cy5®和Cy7®),以及我们优异的水溶性,光稳定性iFluor 和mFluor 染料。然而,常规的生物素-亲和素检测系统仍然受到现有荧光缀合物有限信号强度的限制。链霉亲和素Xtra iFluor缀合物是超亮链霉亲和素缀合物的新家族,其激发和发射性能与Alexa Fluor荧光团几乎相同,信号增强了3到5倍。它是在细胞成像或流式细胞仪中检测低丰度靶标的一组强大工具。iFluor 488是FITC通道成像中常见的绿色荧光色之一。百萤生物是AAT Bioquest的中国代理商,为您提供优质的链霉亲和素-Xtra IF488缀合物。
适用仪器
| 流式细胞仪 | |
| Ex: | 488 nm |
| Em: | 530/30 nm |
| 通道: | FITC 通道 |
| 荧光显微镜 | |
| Ex: | FITC滤波片组 |
| Em: | FITC 滤波片组 |
| 推荐孔板: | 黑色透明底板 |
样品实验方案
溶液配制
1.储备溶液配制
所有未使用的储备溶液应分为一次性使用的等分试样,并在制备后储存在-20°C下。 避免重复冻融循环。
链霉亲和素-Xtra 储备溶液(1 mg / mL):加入100 uL的Cat#46000和1 mL的Cat#46001的ddH2O,制成1mg/mL的储备溶液。注意:此重组溶液在4°C储存并避光保存后,可稳定保存6个月而无明显变化。为了更长的存储时间,可以将重构的溶液分成单次使用的等分试样,或者不分装添加等体积的甘油(浓度为50%),然后将溶液存储在-20°C(避光)。
2.工作溶液配制
链霉亲和素-Xtra 工作溶液:对于IF,建议的染色浓度为1-5 ug / ml。对于FACS,建议在染色浓度为0.1-0.5 ug / 100 uL /百万细胞。注意: PBS + 0.1%BSA可用作染色缓冲液。 注意:为了获得每种应用的性能,需要仔细确定该试剂的浓度。注意: 建议的工作稀释度仅供参考,建议用户在测试中使用适当的阳性和阴性对照对产品进行滴定。
样品示例及操作
- 按照说明书中的建议用目标抗体封闭和处理样品。
- 在样品中以适当的浓度和持续时间添加生物素偶联的二抗工作溶液。注意:请验证您的生物素偶联抗体与实验中使用的一抗的相容性和类型。例如,如果一抗是小鼠抗体,则与生物素结合的山羊抗小鼠抗体可用于该测定。
- 在室温下用链霉亲和素-Xtra 工作溶液孵育细胞30分钟至1小时。 注意: 孵育的时间需要仔细确定。
- 取出工作溶液,然后将细胞重悬在缓冲液中。
- 使用荧光显微镜拍摄图像或使用流式细胞仪记录强度。
图示
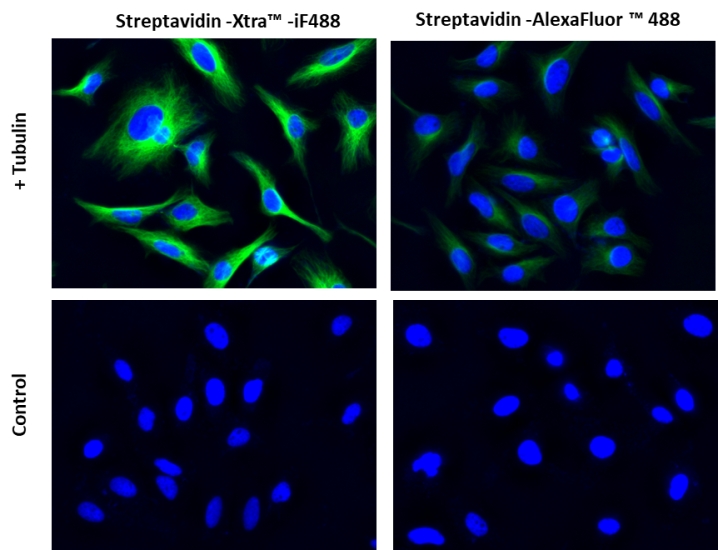
图1.用链霉亲和素-Xtra iFluor 缀合物和链霉亲和素Alexa Fluor 缀合物染色的Hela细胞图像对比。Hela细胞用4%多聚甲醛固定30分钟,用0.02%Triton X-100透化10分钟,并用1%BSA封闭1小时。然后将固定的Hela细胞在室温下用1 µg / mLα微管蛋白小鼠单克隆抗体染色1小时,然后用GxM IgG-生物素(货号16729)染色,然后用Streptavidin-Xtra iFluor 488和Streptavidin-Alexa Fluor 488染色.细胞核用Hoechst 33342(蓝色,货号17535)染色。
参考文献
Highly sensitive electrochemical biosensor for streptavidin detection based on CdSe quantum dots
Authors: Wei, Y. P., Liu, X. P., Mao, C. J., Niu, H. L., Song, J. M., Jin, B. K.
Journal: Biosens Bioelectron (2018): 99-103
Correction to Peptide Tag-Induced Horseradish Peroxidase-Mediated Preparation of a Streptavidin-Immobilized Redox-Sensitive Hydrogel
Authors: Mishina, M., Minamihata, K., Moriyama, K., Nagamune, T.
Journal: Biomacromolecules (2017): 311
Efficient streptavidin-functionalized nitrogen-doped graphene for the development of highly sensitive electrochemical immunosensor
Authors: Yang, Z., Lan, Q., Li, J., Wu, J., Tang, Y., Hu, X.
Journal: Biosens Bioelectron (2017): 312-318
High-sensitive surface plasmon resonance microRNA biosensor based on streptavidin functionalized gold nanorods-assisted signal amplification
Authors: Hao, K., He, Y., Lu, H., Pu, S., Zhang, Y., Dong, H., Zhang, X.
Journal: Anal Chim Acta (2017): 114-120
Biotin-Streptavidin Competition Mediates Sensitive Detection of Biomolecules in Enzyme Linked Immunosorbent Assay
Authors: Lakshmipriya, T., Gopinath, S. C., Tang, T. H.
Journal: PLoS One (2016): e0151153
DNA-based hybridization chain reaction and biotin-streptavidin signal amplification for sensitive detection of Escherichia coli O157:H7 through ELISA
Authors: Guo, Q., Han, J. J., Shan, S., Liu, D. F., Wu, S. S., Xiong, Y. H., Lai, W. H.
Journal: Biosens Bioelectron (2016): 990-995
Facile fabrication of an electrochemical aptasensor based on magnetic electrode by using streptavidin modified magnetic beads for sensitive and specific detection of Hg(2.)
Authors: Wu, D., Wang, Y., Zhang, Y., Ma, H., Pang, X., Hu, L., Du, B., Wei, Q.
Journal: Biosens Bioelectron (2016): 9-13
Highly Sensitive Two-Dimensional Paper Network Incorporating Biotin-Streptavidin for the Detection of Malaria
Authors: Grant, B. D., Smith, C. A., Karvonen, K., Richards-Kortum, R.
Journal: Anal Chem (2016): 2553-7
Increased electrocatalyzed performance through hairpin oligonucleotide aptamer-functionalized gold nanorods labels and graphene-streptavidin nanomatrix: Highly selective and sensitive electrochemical biosensor of carcinoembryonic antigen
Authors: Wen, W., Huang, J. Y., Bao, T., Zhou, J., Xia, H. X., Zhang, X. H., Wang, S. F., Zhao, Y. D.
Journal: Biosens Bioelectron (2016): 142-8
Peptide Tag-Induced Horseradish Peroxidase-Mediated Preparation of a Streptavidin-Immobilized Redox-Sensitive Hydrogel
Authors: Mishina, M., Minamihata, K., Moriyama, K., Nagamune, T.
Journal: Biomacromolecules (2016): 1978-84





