ATTO 488 NHS酯
| Ex (nm) | 499 | Em (nm) | 520 |
| 分子量 | 787.86 | 溶剂 | DMSO |
| 存储条件 | 在零下15度以下保存, 避免光照 |
产品货期
咨询
产品优势
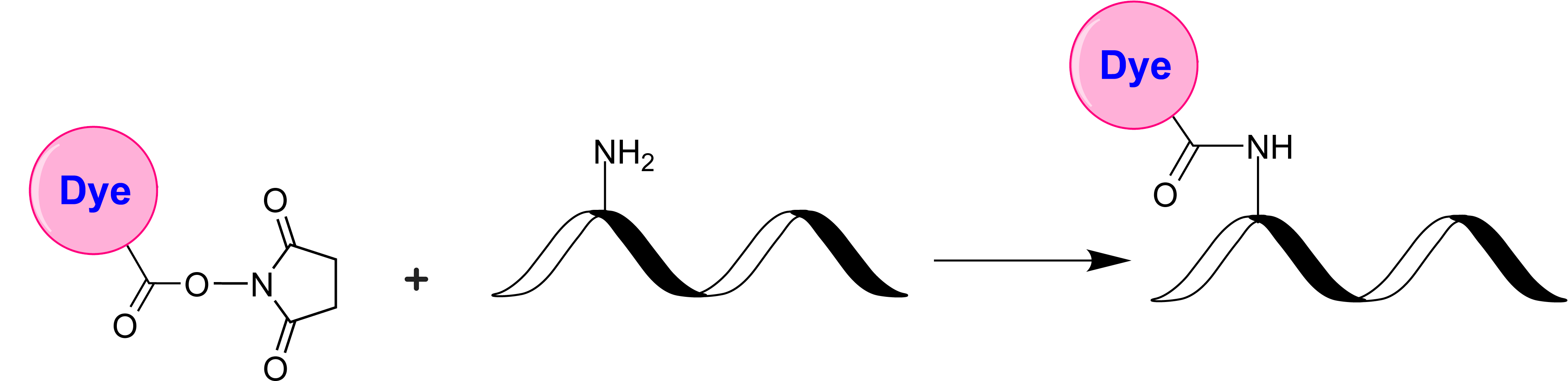
1.易于结合:标记蛋白质和配体上的伯胺,胺修饰的寡核苷酸
2.高量子产率和光稳定性:为敏感应用提供强烈、稳定的荧光
3.高亲水性: 提高了先进成像和活细胞应用的信号清晰度
适用范围
标记蛋白质、胺修饰寡核苷酸和其他含胺分子
产品介绍
AAT Bioquest生产的ATTO 488 NHS酯是胺反应性染料,用于标记氨基。是一种罗丹明的荧光标记。与其他 ATTO 染料不同,它具有优异的水溶性,具有高荧光量子产率、好的光稳定性的特点。适用于单分子检测和高分辨率显微镜技术,包括PALM、dSTORM和STED。ATTO 488还适用于流式细胞术、荧光原位杂交(FISH)和其他各种生物检测。
溶液配制
除非另有说明,所有未使用的储备液应在制备后分装,在 -20°C 下储存避免反复冻融
1.准备蛋白质储备溶液(溶液A):
将 100 µL 反应缓冲液(例如,pH 值约为 8.5 至 9.0 的 1 M 碳酸氢钠溶液或 1 M 磷酸盐缓冲液)与 900 µL 目标蛋白溶液(例如,抗体、蛋白质浓度 > 2 mg/mL(如果可能))混合得到 1 mL 蛋白质标记储备液。
注1:蛋白质溶液(溶液A)的pH值应为8.5±0.5。如果蛋白质溶液的pH低于8.0,则使用1M碳酸氢钠溶液或1M pH 9.0磷酸盐缓冲液将pH调节至8.0-9.0的范围。
注2:蛋白质应溶解于pH7.2-7.4的1X磷酸盐缓冲盐水(PBS)中。如果蛋白质溶解在Tris或甘氨酸缓冲液中,则必须用pH7.2-7.4的1X PBS透析,除去蛋白质沉淀的游离胺或铵盐(例如硫酸铵和乙酸铵)。
注3:不纯的抗体、稳定的牛血清蛋白(BSA)抗体或明胶不会被很好的标记。叠氮化钠或硫柳汞的存在也可能干扰缀合反应。可以通过透析或旋转柱除去叠氮化钠或硫柳汞,获得好的标记结果。
注4:如果蛋白质浓度低于2 mg / mL,标记效率会显着降低。为获得合适标记效率,建议蛋白质浓度范围为2-10 mg / mL。
2.准备染料储备溶液(溶液B):
将无水DMSO加入到ATTO488 NHS 酯小瓶中制备10mM储备溶液。 通过移液或涡旋混合均匀。
注意:在开始缀合前准备染料储备溶液(溶液B),立即使用。 染料储备溶液的长期储存会降低染料活性。 溶液B可在冰箱中保存两周,避光保存。 避免反复冻融。
样本实验方案
(本方案适用ATTO488 NHS 酯标记山羊抗小鼠 IgG,每种蛋白质都需要不同的染料/蛋白质比例,这也取决于染料的性质。蛋白质的过度标记可能影响其结合亲和力,而低染料/蛋白质比率的蛋白质缀合物会降低灵敏度。)
进行偶联反应:
1.使用10:1摩尔比的溶液B(染料)/溶液A(蛋白质)作为起始点:将5μl染料储备溶液(溶液B,假设染料储备溶液为10 mM)加入到样品瓶中。蛋白质溶液(95μl溶液A)有效摇动。假设蛋白质浓度为10mg / mL,蛋白质的分子量为~200KD,蛋白质的浓度为~0.05mM。
注意:建议使用溶液B(染料)/溶液A(蛋白质)的摩尔比为10:1。如果太少或太高,可以尝试5:1、15:1和20:1来确定合适的染料/蛋白质比。
2.在室温下继续旋转或摇动反应混合物30-60分钟
纯化偶联
(以下方案是使用Sephadex G-25柱纯化染料蛋白偶联物的一个例子)
1.按照产品说明准备Sephadex G-25柱。
2.将“进行偶联反应”步骤中的反应混合物装入Sephadex G-25柱的顶部。
3.当样品刚低于顶部树脂表面时,立即加入PBS(pH 7.2-7.4)。
4.向样品中加入更多的PBS(pH 7.2-7.4)完成柱子纯化。将含有目标染料-蛋白质缀合物的组分合并。
注意:如果需要立即使用,染料-蛋白质缀合物物需要用染色缓冲液稀释,并分装。
注意:为了长期储存,染料蛋白缀合物溶液需要浓缩或冷冻干燥。
表征所需的染料-蛋白质偶联物
取代度 (DOS) 是表征染料标记蛋白质的最重要因素。较低 DOS 的蛋白质通常具有较弱的荧光强度,但较高 DOS(例如 DOS > 6)的蛋白质也往往具有减弱的荧光。大多数抗体的最佳 DOS 建议在 2 到 10 之间,具体取决于染料和蛋白质的特性。为了有效标记,取代度应控制为每摩尔抗体有 6-8 摩尔 ATTO 488 NHS 酯。以下步骤用于确定 ATTO 488 NHS 酯标记蛋白的 DOS。
检测吸收率
要测量染料-蛋白质缀合物的吸收光谱,建议根据染料的消光系数将样品浓度保持在 1-10 µM 范围内。
读取 280 nm 处的 OD(吸光度)和染料最大吸光度(对于 ATTO 488 NHS 酯,ƛmax = 499 nm )
对于大多数分光光度计,样品(来自柱馏分)需要用去离子水稀释,以便 O.D.值范围为 0.1 至 0.9。外径(吸光度)280 nm 是蛋白质的最大吸收,而 499 nm 是 ATTO 488 NHS 酯的最大吸收。为了获得准确的 DOS,请确保缀合物不含非缀合染料。
计算DOS
您可以通过以下链接使用我们的工具计算 DOS:https://www.aatbio.com/tools/degree-of-labeling-calculator