别藻蓝蛋白APC
| Ex (nm) | 651 | Em (nm) | 660 |
| 分子量 | ~105000 | 溶剂 | Water |
| 存储条件 | 在2-8度冷藏保存, 避免光照 |
产品货期
现货
产品优势
1.长波长发射曲线有效减少了生物材料的自发荧光
2.藻胆素与蛋白质骨架共价结合,对荧光淬灭的影响极小
3.高的水溶性,便于进行结合反应的化学操作
4.多个位点可与抗体、花菁染料或iFluor染料等有机和合成化合物稳定结合
5.用于多色流式细胞术的串联染料——通过单一激发光产生一系列发射信号
适用范围
主要用于标记抗体
注意事项
1.需要纯化,除去硫酸铵
纯化步骤:①离心;②去掉上清液;③使用PBS溶解沉淀;④使用脱盐柱纯化;⑤浓缩;
2.需要活化,使其可以标记到抗体上(将APC与SMCC反应,使它们带有马来酰亚胺基团)
产品介绍
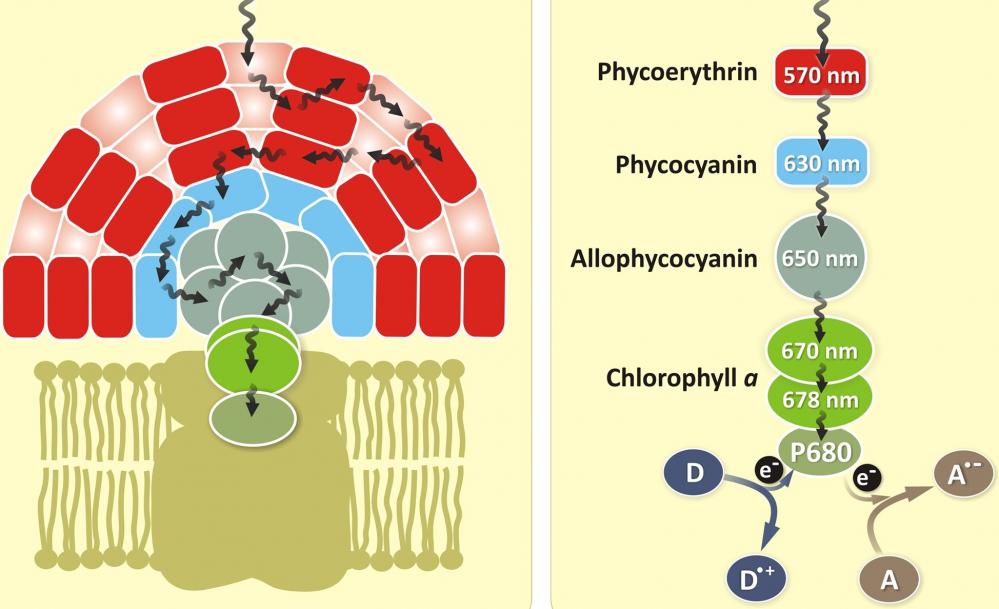
别藻蓝蛋白(APC)是从蓝绿藻螺旋藻中分离出来的一种藻胆蛋白。它表现出明亮的远红色荧光,摩尔消光系数为730000CM -1 M -1,荧光量子产率为0.68。与其他藻胆蛋白一样,具有高的吸收率和量子效率。它是一种蛋白质,可以通过传统的蛋白质交联技术很容易与抗体和其他蛋白质连接,而不改变其光谱特性。APC偶联物常用于流式细胞术、微阵列和ELISA。
通常,当作为硫酸铵沉淀物冷藏储存时,藻胆蛋白具有良好的长期稳定性。纯化的胆脂蛋白可以在酸性或碱性条件下解离成亚基,但在室温下在中性pH下相对稳定,浓度大于0.1mg / mL。解离的亚基通常具有比天然色素更低的着色和荧光。建议将所有藻胆蛋白及其结合物(优选在中性缓冲溶液中)冷藏。
APC偶联抗体的详细参考步骤:APC conjugation of antibodies ((drmr.com))
APC与抗体的缀合实验方案
注1:整个缀合过程可以在一天内完成。但是,缀合前对APC的纯化可能需要24-48小时。除了下面列出的材料外,您还需要浓度至少为 2 mg/ml 的抗体溶液。请您在进行APC抗体缀合实验之前熟悉如何使用脱盐柱以及如何获取吸光度光谱。
注2:SMCC-APC缀合物非常稳定(在“交换缓冲液”中,在 4C 下至少可以稳定几个月)。因此,如果您需要节省一部分时间,可以选择同时缀合10 毫克或更多的 APC,并将其用于几次抗体实验(在几周内)。SMCC-APC 的长期储存最好是作为饱和硫酸铵沉淀物。
一.APC的制备
1.将 APC 纯化。缀合前的浓度通常为 5-10 mg/ml。注意:APC 在缀合前作为 SAS(硫酸铵钠)沉淀物最稳定。如果将 APC 以 SAS 沉淀物的形式储存,则必须在使用前进行大量纯化。在用每毫升 1 升的“透析缓冲液”透析之前,用每毫升 1 升 APC 的 PBS 进行透析 2 次。
2.使用1.7毫克R-APC修饰每毫克IgG,包括在缓冲液交换过程中损失的额外10%。
3.检查 APC 纯度,请测量 280、620 和 655 nm 处的吸光度。 (1 mg/ml 的 APC 在 655nm 处的 OD 为 5.9)。 655/620 比率 >1.4 表明污染藻蓝蛋白被充分去除; 655/280 比率 > 4 表明所有其他蛋白质均已充分去除。
二.APC的活化
1.使用前在无水 DMSO 中制备 10 mg/ml 的 SMCC 储备溶液。
2.每毫克 APC 加入 6 µl SMCC,并进行涡旋。将反应管用铝箔包好,室温下旋转 60 分钟。
3.将纯化的 APC 过凝胶过滤柱来交换缓冲液。
注意:对于失败或效果较差的结合,增加或减少 SMCC 相对于 APC 的量,可能会有所好转。
三.IgG还原
1.在蒸馏水中制备 1 M DTT (15.4 mg/100 µl) 的新鲜溶液。
2.IgG 溶液浓度应为 4 mg/ml 或更高,这样效果比较好。还原几乎可以在任何缓冲液中进行;MES、磷酸盐和 TRIS 缓冲液(pH 范围为 6 至 8)已被验证可以使用。如果抗体浓度低于 2 mg/ml,则应浓缩。缓冲液交换柱上的损失应额外增加 10%。
3.用 DTT 配制 20 mM IgG 溶液:每毫升 IgG 溶液加入 20 µl DTT 原液并搅拌。室温下静置 30 分钟,无需额外搅拌(以尽量减少半胱氨酸再氧化为胱氨酸)。
4.将还原的IgG通过预平衡的“交换缓冲液”过滤柱。收集0.25毫升的级分,测定蛋白浓度,并将含有大部分IgG的级分汇集在一起。可以通过分光光度法或比色法完成。
5.此步骤后尽快进行缀合。
注意:对于结合较差或失败的情况,降低 DTT 浓度可能会有所帮助。
四.进行缀合
1.每毫克 IgG 添加 1.5 毫克 SMCC-APC。用铝箔包裹反应管并在室温下旋转 60 分钟。
注意:这些摩尔比(每 IgG 约 2 个 APC)效果很好。对于失败或效果不佳的结合,不同的摩尔比可能会有所帮助。
2.60 分钟后,必须去掉 IgG 上未反应的游离巯基。
3.在 1.0 ml 干 DMSO 中制备 10 mg NEM 的新鲜溶液。
4.每毫克 IgG 添加 34 µg (3.4 µl)。室温下包裹并旋转 20 分钟。
试剂应用文献
Uncovering the light absorption mechanism of the blue natural colorant allophycocyanin from Arthrospira platensis using molecular dynamics
Authors: Buecker, Stephan and Sanders, Jeffrey M and Winget, Paul and Leeb, Elena and Grossmann, Lutz and Gibis, Monika and Weiss, Jochen
Journal: Food Chemistry (2024): 141834